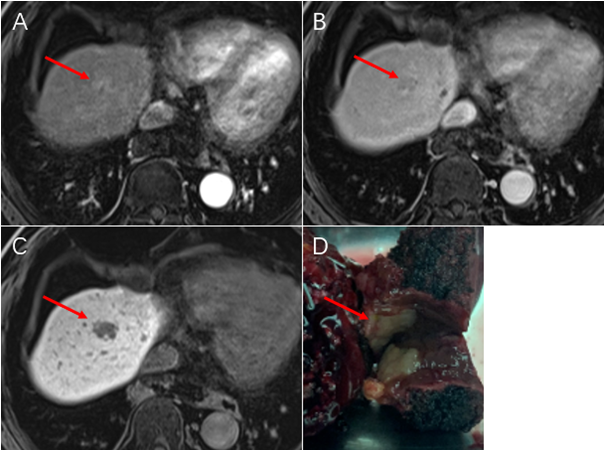
什么是胆管癌? 胆管癌(cholangiocarcinoma,CCA)顾名思义指胆管来源的恶性肿瘤,是一组具有胆道分化病理特征的起源于肝内或肝外的胆管的异质性肿瘤。 但最近也有研究发现这些癌症也可能直接源于肝细胞的转分化。胆管癌是第二常见的原发性肝脏内恶性肿瘤,约占胃肠道恶性肿瘤的3%。临床上,根据其解剖学起源,CCA在解剖学上分为肝内胆管癌(iCCA)、肝门部胆管癌(pCCA)或远端胆管癌(dCCA)。其中,肝门部胆管癌较常见,占同期胆管癌的40%~67%,通常在病理上被归类为腺癌。值得注意的是,胆囊癌在流行病学上不同于胆管癌,病理生物学,临床表现和治疗,应被视为不同形式的胆道癌。 总的来说,这种疾病的发病率在全世界略有上升。部分原因是不明原发性腺癌现在被重新归类为肝内胆管癌。肥胖及相关的非酒精性脂肪性肝病/肝炎的发病率增加可能是包括胆管癌在内的原发性肝脏肿瘤发病率增加的原因。还有诊断技术的提高也部分提高胆管癌的检出率。胆管癌的症状一般为非特异性,包括腹部不适,体重减轻,消化不良,或在常规实验室检查发现无症状但是肝功能检查异常。少数患者在诊断后手术切除,术后复发率仍为60%-70%。本文将系统性地介绍现有的胆管癌的治疗策略。 图1. 肝内胆管癌的发生。(摘自:Giovanni Brandi, and Simona Tavolari. Cells. 2020,9(2): 421.) 胆管癌的手术切除 目前医学界普遍认为手术根治性切除是胆管癌获得长期生存的唯一治疗手段。然而,CCA在早期通常是无症状的,经常在晚期(局部晚期/不能切除或转移)时被诊断。有临床统计表明,10%-45%诊断为可切除疾病的患者在剖腹探查时发现已无法切除。尽管进行了及时的手术和改进的放射治疗提高了根治性切除的可能性,术后复发率仍然很高,术后5年总生存率(OS)在25%-35%之间。复发主要发生在肝内,通常发生在切除术后2-3年内。切除术后的良好预后与肿瘤阴性边缘、无血管侵犯和淋巴结转移以及足够的功能性肝残留有关。 胆管癌的辅助治疗 由于胆管癌手术切除后局部复发或远处转移的发生率很高,因此需要通过手术后的辅助治疗提高术后的效果。辅助治疗包括化疗、放疗或化疗。虽然CCA传统上被认为是一种化疗耐药疾病,但临床试验表明,化疗和放疗在辅助治疗中有一定的作用,尤其对淋巴结阳性的患者,而且全身化疗延长了晚期CCA患者的生存期。通常使用顺铂/吉西他滨进行联合治疗。 晚期(不可切除和转移性)疾病治疗 (3.1)一线化疗 近三分之二的CCA患者被诊断出来时已为晚期,68%-86%的切除病例会在局部或远处复发。因此,化疗仍然是不可切除、转移或复发疾病的主要治疗策略。化疗主要包括吉西他滨、铂化合物和氟嘧啶。有研究表明吉西他滨联合顺铂或奥沙利铂是最有效的治疗方案。 值得注意的是,一线化疗虽然能够提高一些病人的复发或生存的时间。但是受患者的性别、疾病状态、肝转移、转移部位的数量以及生化参数(即血红蛋白、胆红素、白细胞计数、中性粒细胞、碱性磷酸酶,中性粒细胞/淋巴细胞比率和衍生中性粒细胞/淋巴细胞比率)等因素的影响。 (3.2)二线化疗 顺铂/吉西他滨是胆管癌标准的一线治疗方案,但目前还没有标准的二线治疗方案。但是对于一线化疗失败的患者,为了防止胆管癌的迅速恶化通常需要进一步的治疗。20%-40%的患者在日常实践中接受二线化疗。 CCA患者的局部治疗 有些晚期胆管癌患者,由于手术困难(主要是肿瘤的血管或胆管侵犯,常见于肝内和肝门部胆管癌)而无法切除,或者转移侵犯或复发仅累及肝脏,因此,需要肝局部治疗。治疗的策略有: (4.1)肝动脉内治疗 肝动脉内治疗是指由于肝肿瘤的血供优先动脉,通过肝动脉进行的治疗来延缓肿瘤的进展。在CCA中有三种主要方法: (1) 肝动脉灌注(Hepatic artery infication,HAI),指将化疗药物直接注入肝动脉,与全身化疗相似,需要反复进行; (2) 经动脉化疗栓塞(transcatheter arterial embolization,TAE),包括注射化疗药物,将含油造影剂碘油混合或装入药物洗脱珠,然后注射栓塞剂(明胶海绵或校准珠); (3)选择性内放射治疗(selective internal radiation therapy,SIRT),也称为放射性栓塞,包括将放射性同位素(通常为钇-90)注入玻璃或树脂微球。研究表明,有些肝动脉内治疗对肝内胆管癌(iCCA)是有效的。一些最初不能手术切除的肝内胆管癌,经过肝动脉内治疗后达到了外科手术的水平,特别是经过SIRT治疗后。 (4.2)光动力疗法 光动力疗法(photodynamic therapy ,PDT)是指在肿瘤细胞中积累一种光敏药物,用特定波长照射肿瘤部位,能使选择性聚集在肿瘤组织的光敏药物活化,引发光化学反应破坏肿瘤的一种治疗肿瘤的新方法。新一代光动力疗法中的光敏药物会将能量传递给周围的氧,生成活性很强的单态氧。单态氧能与附近的生物大分子发生氧化反应,产生细胞毒性进而杀伤肿瘤细胞。与传统肿瘤疗法相比,PDT的优势在于能够精确进行有效的治疗,而且副作用很小。在CCA中,该技术主要是在不可切除的肺门CCA中使用内镜或经皮进行治疗,取得了初步的有希望的疗效。 (4.3)经皮热消融 借鉴肝细胞癌和结直肠癌肝转移的治疗经验,经皮热消融也被用于治疗原发性或复发性胆管癌。相比微波消融,射频消融是最常用的方式。研究表明经皮热消融是因肝硬化或肝脏其他疾病合并症导致肝功能储备不足而不能进行切除的肿瘤直径≤3cm)患者的一种理想选择。 胆管癌的靶向治疗 近年来,肝内胆管癌的靶向治疗引起了大家的极大兴趣。外显子测序技术表明,30%~40%的肝内胆管癌患者体内存在基因突变,包括FGFR融合、IDH、BRAF和EGFR突变(注:FGFR:fibroblast growth factor receptor,成纤维细胞生长因子受体;IDH:Isocitrate Dehydrogenase 1,异柠檬酸脱氢酶同工酶1、BRAF:v-raf murine sarcoma viral oncogene homologue B1,V-raf鼠肉瘤病毒癌基因同源物B1;EGFR:epidermal growth factor receptor,表皮生长因子受体。)。随着技术的发展,研究表明针对突变进行靶向治疗在临床上是可行的,而且具有明显治疗效果,尤其是靶向FGFR或IDH突变的临床试验具有良好的治疗效果。可见,随着精确的肝内胆管癌药物临床试验的成功,相信在不久的将来,通过基因组数据检测分析并结合精准的靶向治疗,胆管癌的治愈率将大大提高。 胆管癌的免疫治疗 免疫治疗(如PD-1抗体)在其他实体瘤治疗中发挥了非常重要的作用,而且在肝癌中已经开始探索免疫治疗与其他治疗联合的治疗方案。估计10%到15%的胆管癌有DNA修复突变,可以考虑用检查点抑制剂进行免疫治疗。然而在胆管癌中仍然存在一些难以解决的问题,如PD-1抗体单药的疗效远远不如其在肝癌的疗效。值得一提的是,在整个胆管癌患者群体中,有5%左右的患者存在微卫星DNA不稳定的情况。该亚型患者对PD-1抗体的效果非常好。所以对胆管癌患者,确定是否为微卫星不稳定型非常重要。但是,大部分患者并非此类型,单用PD-1抗体的效果并不理想。现在正在探索的联合疗法,如PD-1抗体和靶向药物联用,只有一些非常初步的结论,并不确凿,需要进一步的研究。 小结 与其他消化道肿瘤相比胆管癌发病率相对低,加上该肿瘤的高度异质性,而且存在肝脏或胆道方面的并发症反复发生,导致胆管癌的治疗效果不是很佳。但是随着外科和局部治疗技术的进步,即使在多次手术后也能够解决胆道并发症,使患者获得较好的性能状态和器官功能,大大提高了该病的治疗效果。 而且近几年来,对CCA分子生物学的深入了解,开始大量的有针对性的靶向药物研究开发。值得一提的是针对IDH1和FGFR2途径的两种候选药物都在相应的人群(分别是IDH1突变或FGFR2融合的肿瘤)中表现出良好的的临床试验结果。其他靶向药物处于临床试验的不同阶段,并且正在特定亚群(如抗-HER2、NTRK或PARP抑制剂)中进行测试。另外,免疫治疗,也在尝试用于治疗CCA。 综上所述,希望通过提高诊断技术早发现胆管癌实现早诊断早治疗,提高各种治疗技术、手段增加CCA患者的治疗方案、提高治疗后的预后及生活质量。 
参考文献:
1. Rizvi S, Khan SA, Hallemeier CL, Kelley RK, Gores GJ. Cholangiocarcinoma - evolving concepts and therapeutic strategies.Nat Rev Clin Oncol. 2018 Feb;15(2):95-11
2. Giovanni Brandi and Simona Tavolari. Asbestos and Intrahepatic Cholangiocarcinoma.Cells. 2020 Feb; 9(2): 421.
3. Jorge Adeva, Bruno Sangro, Maximiliano Salati, Julien Edeline, Adelaida La Casta, Alessandro Bittoni, Rosanna Berardi, Jordi Bruix, Juan W Valle. Medical Treatment for Cholangiocarcinoma. Liver Int. 2019 May;39 Suppl 1:123-142.
4. Yun Shin Chun, and Milind Javle. Systemic and Adjuvant Therapies for Intrahepatic Cholangiocarcinoma. Cancer Control. 2017 Sep; 24(3): 1073274817729241.
5. Abou-Alfa GK, et al. Lancet Oncol. pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study. 2020. PMID: 32203698